Esta es una especie de pregunta trampa (pero te está engañando para enseñarte un punto importante, así que es algo justificable).
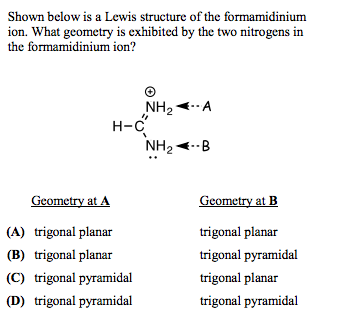
La pregunta dice que la estructura que muestra es "una estructura de Lewis del ion formamidinio", lo cual es técnicamente correcto. Pero hay que tener en cuenta que no la describe como el estructura de Lewis del ion formamidinio, ya que la estructura mostrada es realmente sólo una de las posibles estructuras de resonancia de la molécula.
De hecho, es fácil ver que la disposición del átomos en la molécula es simétrica, y que la estructura mostrada puede convertirse en su imagen especular, con los nitrógenos A y B intercambiados, simplemente barajando los electrones. Esta simetría sugiere fuertemente que tanto la estructura de Lewis mostrada como su imagen en el espejo deberían ser igualmente contribuyentes importantes a la resonancia, y que la configuración de energía mínima real de la molécula será un híbrido simétrico de las dos estructuras (y posiblemente otros contribuyentes menores), con ambos nitrógenos teniendo exactamente la misma geometría y enlace.*
Este argumento de simetría descarta las respuestas asimétricas B y C, dejando sólo dos opciones plausibles: o bien ambos nitrógenos son trigonales planos, o bien ambos son trigonales piramidales. Dado que las estructuras de Lewis que contribuyen a la resonancia presentan un C=N doble enlace En este caso, su híbrido de resonancia debe implicar presumiblemente algún grado de enlace π entre el carbono central y los nitrógenos. Esto sugiere que ambos nitrógenos (y el carbono central) deben estar hibridizados sp², y por lo tanto planares.
*) En principio, la geometría molecular correspondiente a la estructura híbrida de resonancia simétrica también podría ser una energía local máximo Por ejemplo, debido a la repulsión estérica, la verdadera geometría de energía mínima es asimétrica y favorece (arbitrariamente) una de las estructuras de Lewis de imagen especular sobre la otra. No se me ocurre ningún ejemplo concreto de una molécula en la que ocurra eso, pero estoy seguro de que deben existir. Sin embargo, en el caso de moléculas pequeñas y sencillas como ésta, suele ser bastante seguro que si puede existir un híbrido de resonancia simétrica, probablemente sea la configuración de energía mínima.



0 votos
chemistry.stackexchange.com/questions/4390/ chemistry.stackexchange.com/questions/4390/