Esta respuesta utiliza electronegatividades para el cálculo de estados de oxidación, tal como se propuso en la Definición Ampliada del Estado de Oxidación por Hans-Peter Loock en 2011.
Comparando Electronegatividades
La siguiente tabla muestra un extracto de las electronegatividades de Pauling (χPauling):
ElementoχPaulingH2.20N3.04
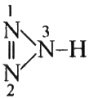
Analizando el Enlace N−H (heteroatómico)
La tabla muestra que el átomo de nitrógeno es más electronegativo que el átomo de hidrógeno. Por lo tanto, atraerá los electrones más que el hidrógeno, polarizando así el enlace. Al imaginar el experimento mental de una ruptura de enlace heterolítico hipotético - suponiendo que se aplica fuerza de tracción a los átomos hasta que se separan - se asume que los electrones se asignan al átomo de nitrógeno durante la separación.
![Comportamiento para el enlace N-H heteroatómico]()
Analizando los Enlaces N−N y N=N (homoatómicos)
Observando nuevamente el experimento mental anterior, ahora con dos átomos idénticos unidos entre sí. Dado que tienen, por supuesto, la misma electronegatividad, no hay polarización del enlace. Se asume que la separación resultaría en una ruptura de enlace homolítico, asignando siempre un electrón a cada uno de los dos átomos de nitrógeno para cada enlace respectivamente.
![Comportamiento para el enlace N-N o N=N homoatómico]()
Resumiendo
Ahora, al observar la estructura completa de la molécula en cuestión y aplicando las reglas previamente establecidas:
![Aplicando reglas a la molécula objetivo]()
Lo último que hay que hacer es calcular la carga hipotética de los átomos después de la separación, que debe ser equiparable al estado de oxidación:
Estado de Oxidación=Ni(eX−)−Nf(eX−)
Donde Ni(eX−) representa el número de electrones en un átomo libre, y Nf(eX−) el número después de la separación (No se deben olvidar los pares solitarios).
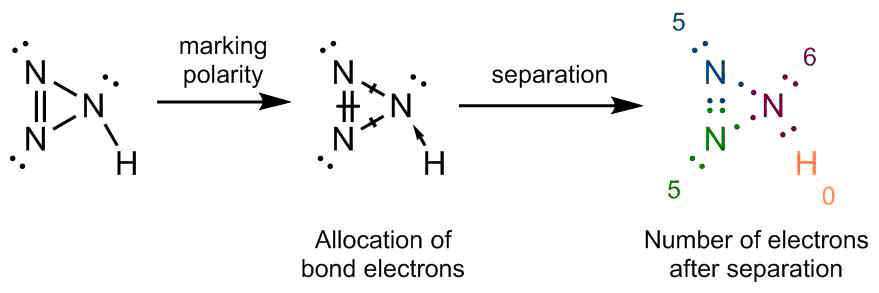
Se obtendrán los siguientes estados de oxidación para los diferentes átomos (de nitrógeno), con la última entrada representando el estado de oxidación medio de todos los átomos de nitrógeno:
ÁtomoNi(eX−)Nf(eX−)Estado de OxidaciónH10+1N-1550N-2550N-356−1N−−−13
Y la estructura con los estados de oxidación asignados:
![Los estados de oxidación de la molécula objetivo]()

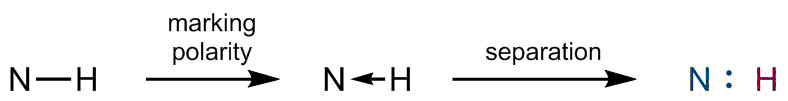
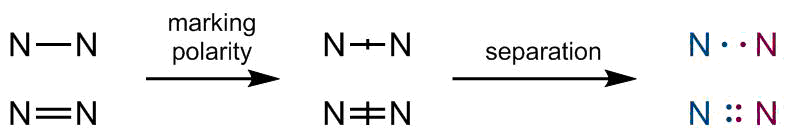
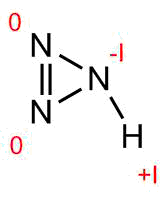


12 votos
Tira el libro. Esta estructura está horriblemente equivocada. Y de todas maneras, puedes asignar estos estados de oxidación de manera más o menos arbitraria (solo asegúrate de que sumen 0), así que realmente no importa.
2 votos
Para ser justos, él no dice si el libro llama a esto ácido hidracínico, o si es él quien lo llama así. Greenwood y Earnshaw mencionan brevemente lo anterior, así que asumo que de alguna manera se sabe.
2 votos
La estructura dada pertenece a triazirina, no ácido hidracílico.
1 votos
Triazirina y ácido hidroazóico tienen la misma fórmula molecular pero estructura diferente-guidechem.com/product/search_HN3_w-formula-p1.html
0 votos
Ok, ¿cómo está el triazireno? Es antiaromático si es planar y altamente tensionado.
1 votos
@OscarLanzi He eliminado el comentario. Los compuestos son inestables y es posible que se hayan descompuesto simplemente por estar en la sección de comentarios durante 5 años. (Lo siento por la broma terrible).