La respuesta radica en la estructura de bandas de los dos materiales. La estructura de bandas describe cómo están ligados los electrones en un sólido y qué otros estados de energía están disponibles para ellos.
Muy simplemente, la distancia de banda para diamantes transparentes es muy amplia (ver este enlace):
![introducir descripción de la imagen aquí]()
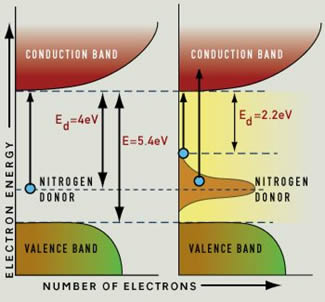
Normalmente, el diamante no es un conductor: todos los electrones están en la "banda de valencia" y se necesita un fotón con al menos 5,4 eV de energía para empujar un electrón a la banda de conducción. En el proceso, ese fotón sería absorbido. Un fotón con menos energía no puede transferir su energía a un electrón, porque ese electrón "no tiene a dónde ir". Y dado que la luz visible tiene energías entre 1,65 y 3,1 eV, solo los fotones UV tienen la suficiente energía para ser absorbidos por un diamante puro.
Ese mismo enlace también describe cómo las impurezas dan origen al color en el diamante: por ejemplo, los átomos de nitrógeno producen un nivel de energía "intermedio" y eso da lugar a electrones más energéticos que podrían saltar la distancia hasta la banda de conducción y absorber luz.
Por el contrario, el grafito es un conductor. Siendo conductor, ya tiene electrones en la banda de conducción. Lo sabemos porque incluso un pequeño voltaje dará origen a una corriente, esto nos dice que los electrones no necesitan ser "elevados" a la banda de conducción primero. Y dado que los electrones absorberán cualquier cantidad de energía fácilmente, el material absorbe todas las longitudes de onda de la luz: lo que lo hace negro.



3 votos
Solo una nota rápida - la estructura cristalina del diamante es en realidad cúbica. En cada átomo de carbono, los vecinos más cercanos están en una configuración tetraédrica (por lo que el grupo puntual es tetraédrico), pero las celdas unidad más simples de la red son cubos.