La sacarosa se descompone a 186 °C. No se derrite, pero cuando alcanza la temperatura de descomposición, la sacarosa se descompone en fructosa y glucosa.
Después de enfriarse y endurecerse, ya no es sacarosa. ¿Estoy en lo correcto?
La sacarosa se descompone a 186 °C. No se derrite, pero cuando alcanza la temperatura de descomposición, la sacarosa se descompone en fructosa y glucosa.
Después de enfriarse y endurecerse, ya no es sacarosa. ¿Estoy en lo correcto?
Estás en su mayoría en lo correcto. La sacarosa es un disacárido compuesto por glucosa y fructosa.
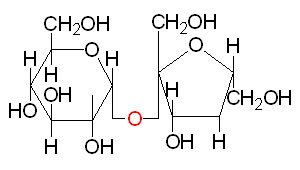
Es un material cristalino. Calentar la sacarosa resulta en un proceso térmico complejo que implica tanto la fusión como la descomposición. Dependiendo de qué tan rápido lo calientes, observarás diferentes cosas. Básicamente, la sacarosa comenzará a descomponerse cuando comience a fundirse. Si hay algo de agua presente durante el proceso de calentamiento, entonces ocurrirá una reacción conocida como inversión de sacarosa y la sacarosa se descompondrá en sus componentes, una molécula de glucosa y una molécula de fructosa.
Sin embargo, si se calienta sacarosa seca hasta su punto de fusión \ descomposición, entonces ocurren cosas más complejas. Se detectan cantidades significativas de glucosa inicialmente. El calentamiento continuo conduce a la "caramelización". La caramelización es un proceso de condensación donde el agua se elimina de la sacarosa; la pérdida inicial de agua es seguida por la isomerización y la polimerización. Se cree que se forman más de 4,000 productos durante la caramelización. Cuando esta mezcla compleja se enfría, ya no es sacarosa.
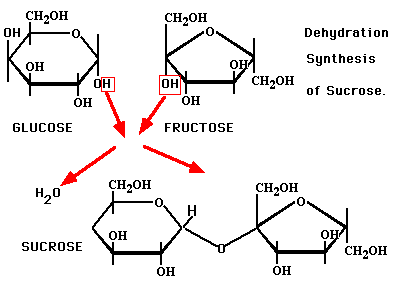
Lo que estás haciendo cuando calientas un azúcar como la sacarosa es deshidratarlo. La estructura cristalina de la sacarosa se descompone y las moléculas se descomponen en glucosa y fructosa y luego pierden agua y se convierten en isómeros y polimerizan para formar caramelo, un sólido de color rojo anaranjado a temperatura ambiente. Sin embargo, hay varios otros productos además de fructosa y glucosa. La caramelización no se entiende muy bien, por lo que no puedo darte una respuesta directa indicando todos los productos formados.
Puedes hacer esto en casa, solo pon azúcar de mesa en una olla y caliéntala. El mismo tipo de proceso se utiliza en la elaboración de caramelos.
La sacarosa sí se derrite a $\pu{366.8 ^\circ F}$. Se descompone una vez que se alcanzan temperaturas más altas, por eso el caramelo se oscurece hasta convertirse en azúcar quemada. Por lo tanto, a diferencia del cloruro de sodio y la mayoría de las otras sustancias, la sacarosa y muchos otros azúcares desde triosas hacia arriba en el número de carbonos no tienen un punto de ebullición, solo un punto de fusión porque el calor rompe los enlaces $\ce{C-C}$, $\ce{C-H}$ y $\ce{C-O}$ más en los azúcares que en otras moléculas orgánicas. ¿La razón exacta?
Desde $\ce{R-C-O}$ es fácil formar dióxido de carbono, y también hay un $\ce{-OH}$ unido a uno de los carbonos del cual el agua puede formarse fácilmente.
Cuando lo derrites, rompes los enlaces y si rompes los enlaces, entonces no es sacarosa. Entonces, lo que estás diciendo es que si se derrite a la temperatura correcta por la cantidad correcta de tiempo con la cantidad adecuada de líquido, se derretirá pero no debe ser nada más que monosacáridos o disacáridos, por lo que no debe haber azúcar en el líquido excepto por la sacarosa
I-Ciencias es una comunidad de estudiantes y amantes de la ciencia en la que puedes resolver tus problemas y dudas.
Puedes consultar las preguntas de otros usuarios, hacer tus propias preguntas o resolver las de los demás.
2 votos
No hay un punto de fusión fijo para la sacarosa. Este artículo explica qué sucede realmente cuando la sacarosa se calienta. mobile.foodnavigator.com/Science/…