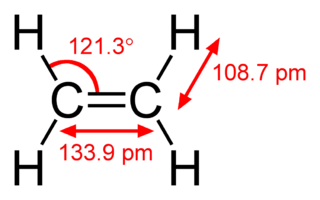
Con respecto a la imagen de arriba, ¿por qué es el $\ce{C-C}$ $\sigma$ de bonos compuesta de dos $\ce{sp^2}$ mientras que la de los orbitales $\ce{C-H}$ $\sigma$ bonos compuesto de $\ce{sp^3}$ orbitales híbridos? No veo por qué, me parecía que la geometría alrededor de los átomos de carbono se trigonal planar. ¿Por qué la hibridación difieren a través de los átomos en la molécula?
Estoy pensando en el libro de texto de autores cometido un error; sí, hay cuatro $\ce{C-H}$ en bonos, pero esto no significa que exista $\ce{sp^3}$ hibridación porque hay dos átomos de carbono, cada uno con dos $\ce{C-H}$ bonos y un $\ce{C-C}$ bonos. Quizás los autores tomaron equivocadamente allí para ser uno de carbono y cuatro $\ce{C-H}$ de los bonos (es decir, el metano.) Que sería de $\ce{sp^3}$ hibridación.
O tal vez estoy equivocado por completo. Por favor me ilumine!
EDIT: Vi esto en otro texto: