El orden de enlace, y por tanto el estado de valencia del Cl en $\ce{ClO_{x}-}, x>1$ compuestos es muy discutible. En general, existen dos modelos.
-
$\ce{Cl}$ átomo, al igual que $\ce{S, P}$ y algunos otros ha desocupado $d$ -orbitales en la cáscara de valencia. Es posible mover algunos electrones de $p$ -Orbitales a $d$ -orbitales, produciendo orbitales semiocupados que pueden participar en la formación de enlaces covalentes
-
$\ce{O}$ El átomo tiene 6 electrones en la capa de valencia con cuatro orbitales. Es posible mover un electrón del átomo de cloro al átomo de oxígeno para formar $\ce{O^{\dot{-} }}$ que puede entonces formar un enlace con el nuevo orbital medio lleno del cloro. Sin embargo, al ser electronegativo y tener una alta carga positiva, el cloro retira parcialmente el par de electrones del enlace recién formado.
Actualmente la segunda opción está a favor de los teóricos, tanto por el análisis de la población de electrones como por las cargas relativamente altas en los compuestos oxiclorados, sin embargo, en la química de nivel escolar se recurre tradicionalmente a la primera opción. Por otra parte, el segundo enfoque es la única opción para describir adecuadamente el ácido nítrico y los nitratos, ya que el nitrógeno no tiene $d$ -orbitales en la capa de valencia.
Ahora bien, la estabilidad de los compuestos oxiclorados es un asunto completamente diferente. Todos ellos son compuestos poco estables, que liberan fácilmente su oxígeno. Aún así, el proceso tiene una energía de activación significativa, el estado intermedio es aún menos favorable que la molécula de oxicloro. tanto el oxígeno como el cloro tienen conchas ricas en electrones que repelen a los reactivos potenciales. El ion perclorato es especialmente estable, en su superficie está completamente cubierto por las cáscaras negativas externas del oxígeno, por lo que los electrones no pueden llegar al cloro cargado positivamente.
 $\rightarrow$ Iones de perclorato
$\rightarrow$ Iones de perclorato $\rightarrow$ "Ácido cloroso que contiene ion clorito
$\rightarrow$ "Ácido cloroso que contiene ion clorito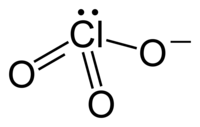 $\rightarrow$ "Ion clorato
$\rightarrow$ "Ion clorato

