Las moléculas de agua son polares; esto básicamente significa que tienen un "lado positivo" y un "lado negativo"
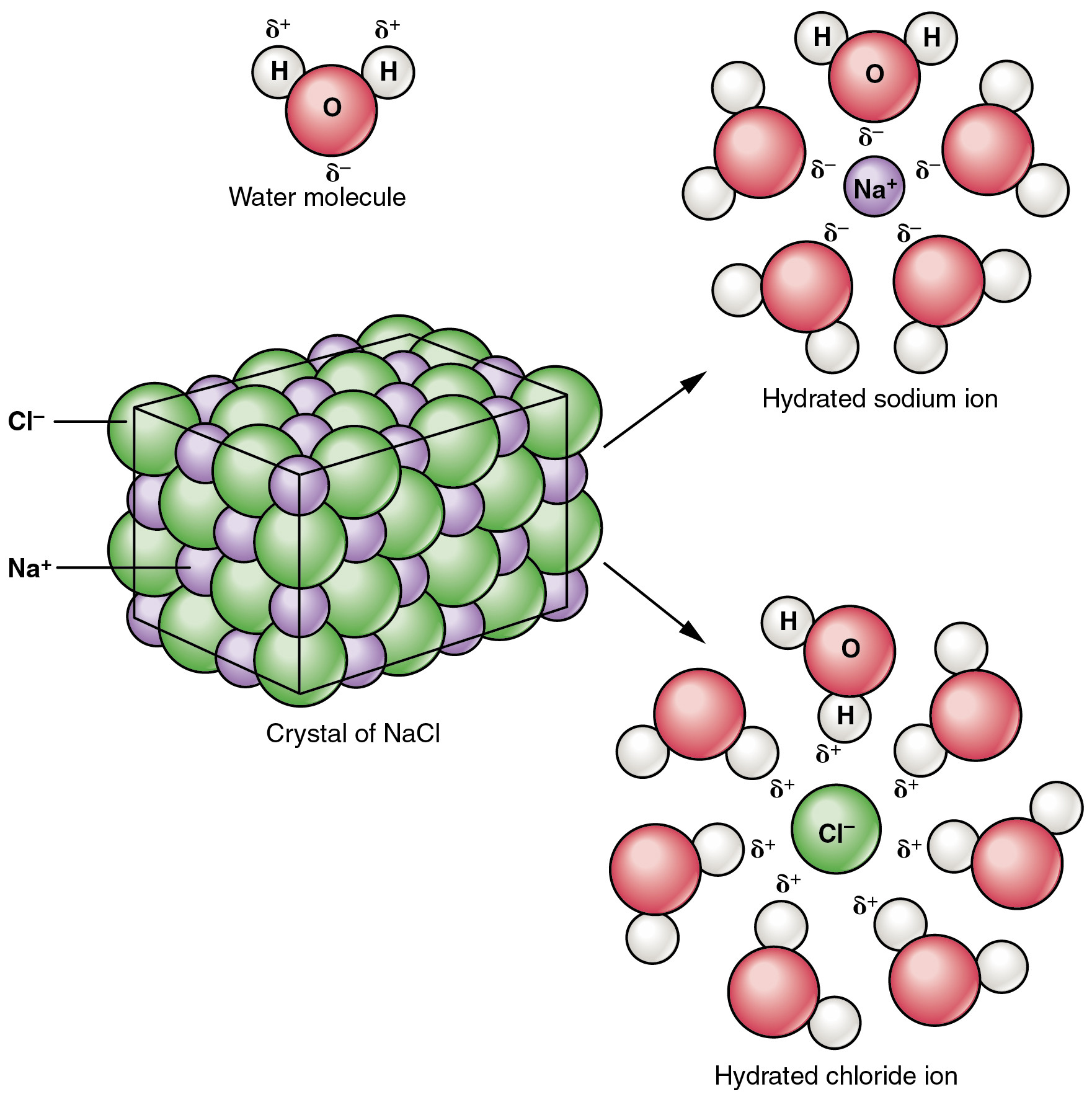
La sal está compuesta por iones Na$^+$ y Cl$^-$ unidos por fuerzas electrostáticas (es un compuesto iónico). Cuando la sal se disuelve en agua, se disocia, es decir, los iones Na$^+$ se separan de los iones Cl$^-$.
Cuando están en el agua, dichos iones están rodeados por moléculas de agua que les muestran el lado opuesto a la carga del ion; esto se debe a que de esta forma pueden alcanzar un estado de energía más bajo, ya que su campo electrostático se ve amortiguado por el de las moléculas de agua (imagen abajo [fuente]).
![enter image description here]()
El agua se evapora cuando la energía térmica de las moléculas es lo suficientemente alta como para romper aproximadamente la mitad de los enlaces de hidrógeno entre ellas [fuente]. Para los iones, es mucho más difícil evaporarse, ya que su energía térmica tendría que ser suficiente para compensar el efecto de las moléculas de agua que los rodean.
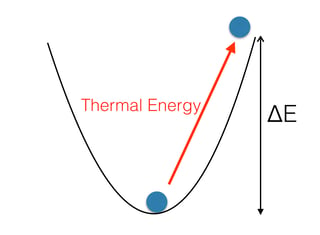
Básicamente, tanto las moléculas de agua como los iones están en lo que se llama un pozo de energía potencial: para "sacarlos" del pozo, debemos proporcionarles una energía tan alta como la profundidad del pozo de energía $\Delta E$ (imagen abajo).
![enter image description here]()
La profundidad del pozo en el que se encuentran las moléculas de agua (debido a la formación de enlaces de hidrógeno) es mucho menor que la profundidad del pozo en el que se encuentran los iones. Por lo tanto, se necesita una energía térmica mucho mayor para sacar un ion del agua. Dado que la energía térmica es proporcional a $k_B T$, donde $k_B$ es la constante de Boltzmann, esto significa que se necesita una temperatura mucho más alta.
Actualización: Algunos números
Para tener una idea del orden de magnitud de las energías involucradas, debemos considerar lo siguiente:
- A temperatura ambiente ($T_r\simeq298$K), $k_B T_r = 0.026$ eV (sin embargo, debemos tener en cuenta que esto es solo un orden de magnitud...)
- La energía de un enlace de hidrógeno (entalpía de enlace de hidrógeno) en agua es de alrededor de $23.3$ kJ/mol = $0.24$ eV = $9.3 \ k_B T_r$, y para que un volumen de agua se evapore, aproximadamente la mitad de todos los enlaces de hidrógeno en el volumen deben romperse:
No hay una definición estándar para la energía del enlace de hidrógeno. En el agua líquida, la energía de atracción entre las moléculas de agua (entalpía de enlace de hidrógeno) es aproximadamente $23.3$ kJ/mol (Suresh y Naik, 2000) y casi cinco veces la fluctuación promedio de las colisiones térmicas a $25$°C. Esta es la energía necesaria para romper y separar completamente el enlace, y equivale a aproximadamente la mitad de la entalpía de vaporización ($44$ kJ/mol a $25$°C), ya que se rompe un promedio de casi dos enlaces de hidrógeno por molécula al evaporarse el agua. [fuente]
- La energía obtenida al colocar un ión en agua (término técnico "hidratar" al ión) se conoce como la energía de hidratación o entalpía de hidratación ($\Delta H_{hyd}$). Dado que estamos interesados en el proceso contrario (la remoción o deshidratación del ión), debemos considerar $-\Delta H_{hyd}$. Aquí podemos encontrar algunos números. Podemos ver que
$$\Delta H_{hyd}(\text{Na}^+) = -406 \ \text{kJ/mol} = -4.2 \ \text{eV} = -162\ k_B T_r$$
$$\Delta H_{hyd}(\text{Cl}^-) = -363 \ \text{kJ/mol} = -3.8 \ \text{eV} = -145 \ k_B T_r$$



4 votos
Creo que es mejor pensar en términos de energía que en términos de tamaño/masa en este caso. La sal se disuelve en agua como iones cargados de Na+ y Cl-. Cuando las moléculas de agua evaporan, es difícil para los iones individuales de Na+ o Cl- engancharse en ellas para ascender hacia la atmósfera porque eso aumentaría en gran medida la energía electrostática asociada con la molécula de agua. Así que el agua se evapora mientras que los iones de Na+ y Cl- tienden a quedarse atrás.
0 votos
Samuel, ¿podrías elaborar? Este es un aspecto muy interesante de la evaporación. Quiero decir que entiendo que cuanto más agua se evapora, más iones de Na y Cl se unen nuevamente y forman cristales. Pero aún no veo cómo es
difícil para los iones individuales de Na o Cl aferrarse a ellos para un viaje... Probablemente esto se debe a que realmente no entiendo cómo el agualimpiase evapora. ¿Está evaporándose como moléculas completas o también se descompone en algunos iones/átomos?1 votos
Alex, el agua se evapora como moléculas completas. Serían necesarias temperaturas extremadamente altas para comenzar a descomponer las moléculas de agua en sus átomos constituyentes. En cuanto a las consideraciones de energía involucradas aquí con el agua y el NaCl disuelto, hay una explicación agradable y fácil de entender aquí: van.physics.illinois.edu/qa/listing.php?id=1490
3 votos
En realidad, el mar es salado porque el vapor no lo es.
0 votos
@RomanReiner no realmente; es salado porque los minerales se han disuelto en él. Si el vapor fuera salado (lo que sea que eso signifique...), entonces la lluvia sería salada, y los ríos serían salados, devolviendo la sal al mar, con un poco más disuelto en él, aumentando el nivel de sal con el tiempo. Posiblemente alcanzaría un equilibrio después de mucho tiempo, pero no a los niveles actuales de sal.