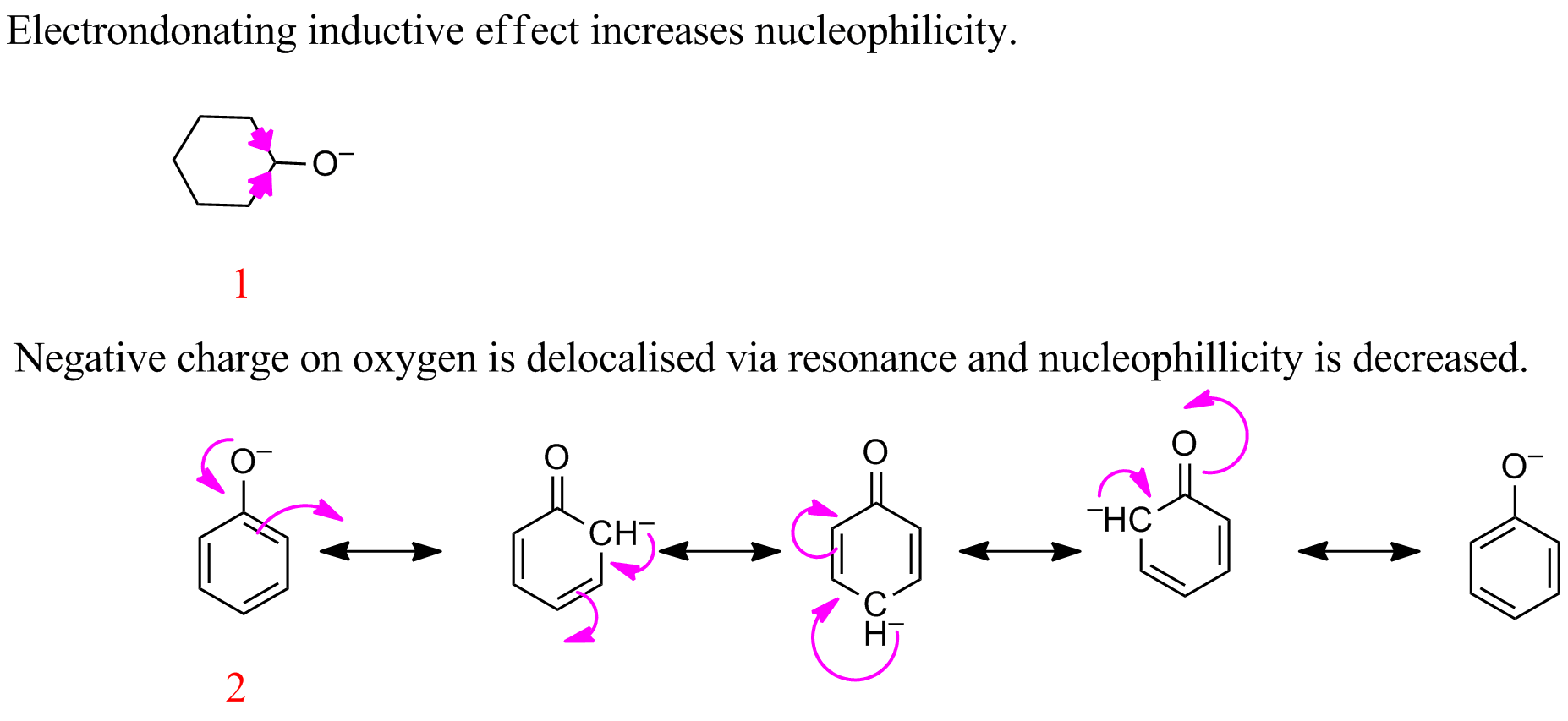
La fuerza de un nucleófilo en un solvente polar aprotico es proporcional a su basicidad. El par solitario en O- en las moléculas donará un par de electrones a un átomo. No estoy seguro de por qué el anillo de alqueno en 2 lo convierte en un nucleófilo peor en comparación con 1. El anillo de benceno es más estable que el ciclohexano pero el doble enlace no es el nucleófilo en la molécula. ¿Es debido a impedimento estérico?
Respuestas
¿Demasiados anuncios?Comencemos con la nucleofílicidad de los haluros. En solvente protónico polar, $\ce{F^-}$ está más solvatado (enlace de hidrógeno) que $\ce{I^-}$ y, por lo tanto, es menos reactivo.
En solvente aprótico polar, la solvación de $\ce{F^-}$ es menor y, por lo tanto, es más reactivo.
Tal comportamiento puede no aplicarse aquí, ya que el fenóxido está estabilizado por resonancia mientras que el otro compuesto no lo está. Por lo tanto, el fenóxido $\bf{2}$ es menos nucleofílico que el ciclohexasanoato $\bf{1}$.
Un solvente polar aprotico no forma enlaces de hidrógeno con nucleófilos en una medida significativa, lo que significa que los nucleófilos tienen mayor libertad en solución. Bajo estas condiciones, la nucleofilicidad se correlaciona bien con la basicidad - y el ion fluoruro, siendo el más inestable de los iones haluros, reacciona más rápidamente con los electrófilos.