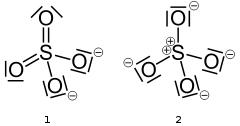
Supongo que una forma alternativa de hacer esta pregunta es cuál es la hibridación de H2SO4?
Una mejor manera de hacer esta pregunta podría ser: "¿Cuál es la hibridación del átomo de azufre en Sulfato de Hidrógeno?"
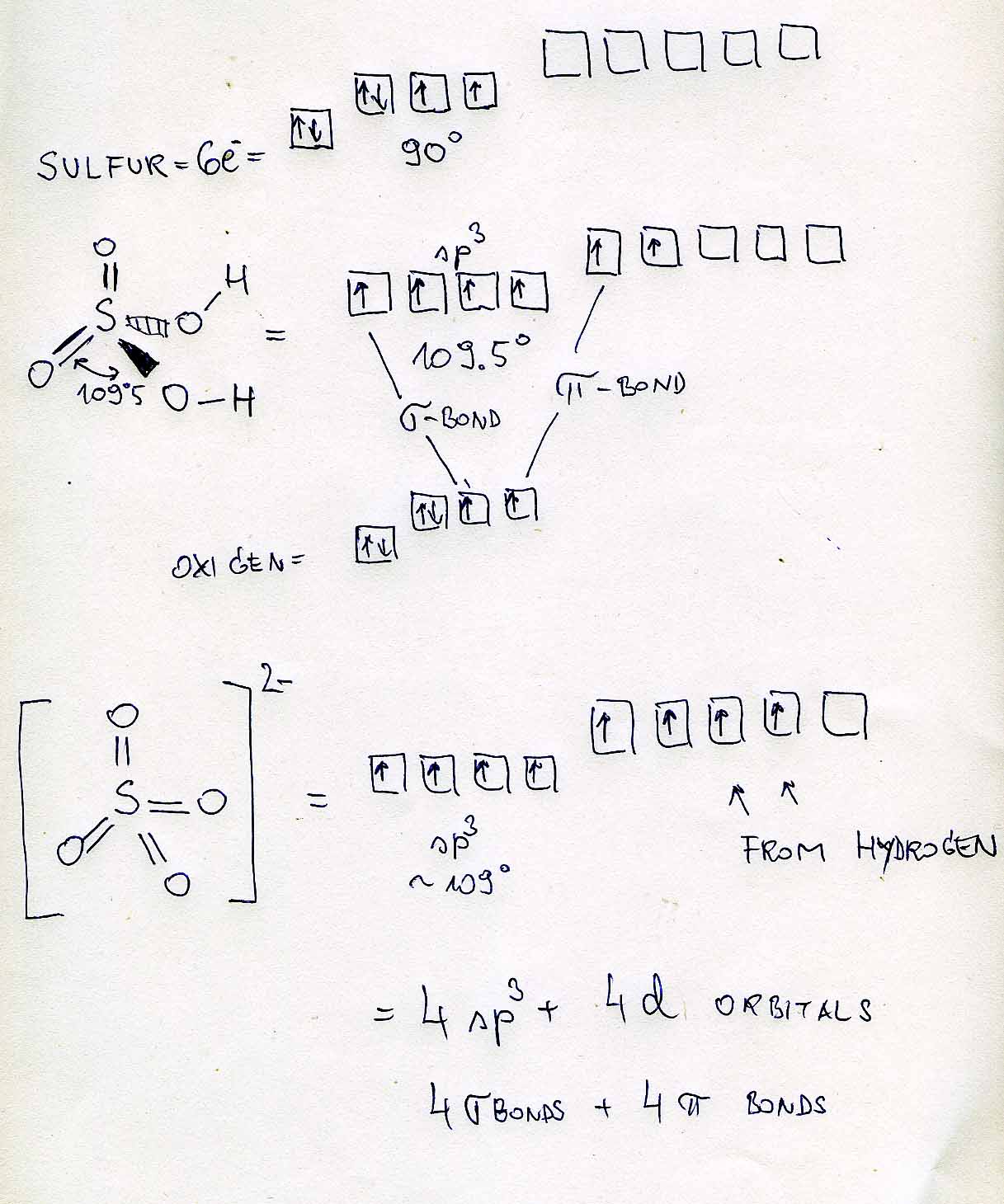
El átomo de azufre tiene un enlace con cuatro átomos más en esta molécula. Debido a que los electrones tratan de mantenerse lo más alejados posible según la Teoría de Repulsión de Pares de Electrones de la Capa de Valencia (VSEPR), los otros átomos se separarán lo más posible, lo que resulta en enlaces que están a 109.5 grados de distancia uno del otro. Si esto fuera una disposición plana cuadrada, los enlaces estarían solo a 90 grados de distancia, lo cual no sería tan satisfactorio como la disposición tetraédrica proporcionaría.
Según mi libro, si el número de pares efectivos es 4, la disposición es tetraédrica, y por lo tanto la hibridación requerida es sp3sp3
Fuente: Zumdahl, Zumdahl, Chemistry: An Atoms First Approach
ISBN-13: 978-0840065322
Esto ciertamente responde la pregunta, ¿pero por qué?
Tiene que ver con los orbitales moleculares, y cómo solo contienen cierta cantidad de electrones, y prefieren distribuirse uniformemente porque en el mundo cuántico, los electrones tienden a preferir el estado de energía más bajo posible. Una vez que el enlace sigma está ocupado, que es el primer orbital referido como el orbital s, los electrones terminan ocupando los orbitales p, y cuando los electrones se comparten a través de estos orbitales se llaman enlaces pi, en realidad forman un nuevo orbital completo, un orbital molecular, que permite el intercambio de electrones entre dos átomos. Permítame referirle a este sitio web para ayudarlo visualmente a mostrarle qué está sucediendo.