Observando las electronegatividades de Pauling en la Tabla Periódica (abajo, de ChemWiki):
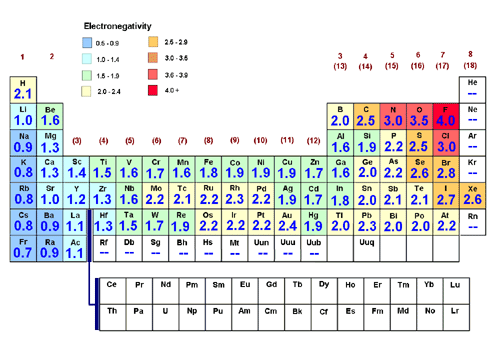
Además de la tendencia general de aumento de electronegatividad a través y hacia arriba de la Tabla Periódica (hacia el flúor), parece haber un pico menor en los primeros 3 periodos de los elementos del bloque $d$, este pico se vuelve más pronunciado a medida que desciendes en el bloque $d$, con los picos más notables en los Períodos 5 y 6 - aparentemente al revés de la tendencia general. Esto se muestra en el gráfico a continuación (Fuente de la imagen):
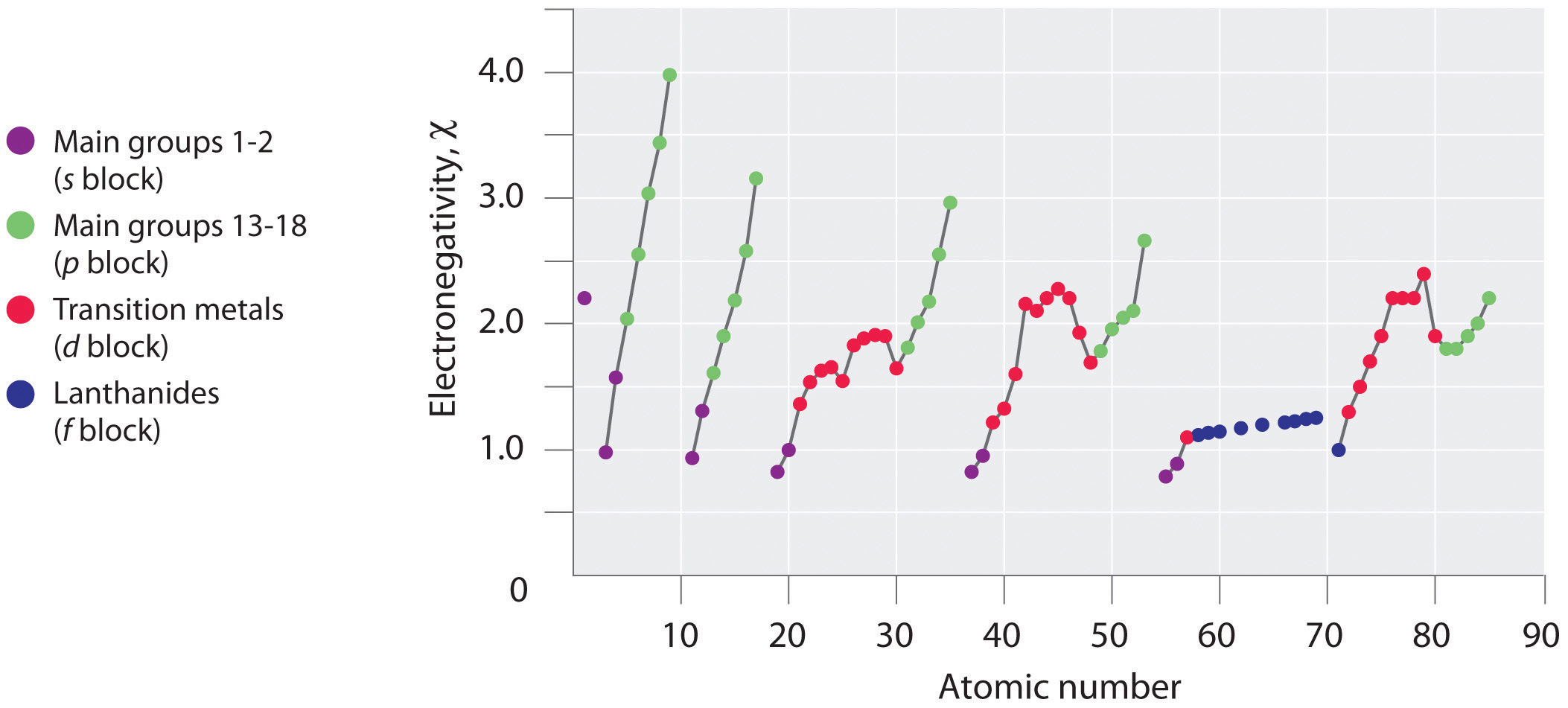
En la página de ChemWiki, también hay una referencia a la Escala de Electronegatividad de Allred-Rochow, que también tiene picos que ocurren de manera más prominente en los Períodos 4 y 6:

La página de Wikipedia Electronegatividad detalla varios métodos de cálculo, lo que pone en duda cuán bien definidos están los valores de electronegatividad; sin embargo, aún parece haber picos que ocurren, particularmente en los Períodos 5 y 6, y en menor medida en el Período 4.
¿Cuál es la razón de estos picos de electronegatividad en el bloque $d$?