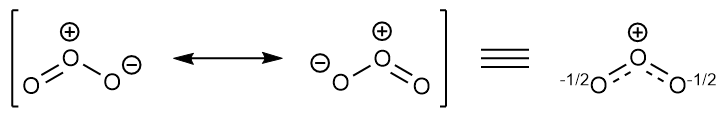
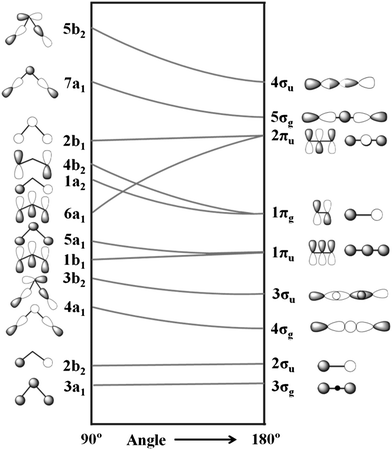
Aquí está el diagrama de Walsh que muestra todos los orbitales moleculares de valencia (un diagrama que muestra cómo cambian en energía los orbitales moleculares individuales debido a la flexión alrededor del átomo central). El oxígeno tiene 6 electrones de valencia, por lo que el ozono tiene un total de 18 electrones. Si comenzamos en la derecha, donde el ozono sería lineal, podemos ver que todos los orbitales hasta los orbitales $2\pi_\mathrm u$ (no te preocupes por por qué se llaman así) estan doblemente ocupados y los dos orbitales $2\pi_\mathrm u$ están ocupados individualmente.
![Diagrama de Walsh]()
Nota: 6a$_1$ y 2b$_1$ tienen el signo incorrecto en los orbitales p externos.
Si doblamos ligeramente la molécula (moviéndonos hacia la izquierda en el diagrama), podemos ver que hay una interacción favorable entre los orbitales de tipo p en los extremos, así como entre el negro del orbital p central y el negro de los orbitales de tipo p externos (Alguien dibujó los orbitales $\mathrm{6a_1}$ y $\mathrm{2b_1}$ incorrectamente, da vuelta el orbital central). Esto reduce la energía de la molécula.
Entonces, ¿por qué no sigue doblandose? Como una buena aproximación de primer orden, podemos estimar la energía relativa de las configuraciones por el orbital de mayor energía (si los otros orbitales no cambian demasiado). Podemos ver que si seguimos doblando, el orbital $\mathrm{1a_2}$ y el orbital $\mathrm{4b_2}$ comienzan a aumentar en energía, eventualmente subiendo por encima del orbital $\mathrm{6a_1}$. Así que doblar demasiado será desfavorable, y por lo tanto el ozono prefiere un ángulo de enlace de alrededor de $117^\circ$.
Este mismo diagrama se puede utilizar para otras moléculas, como $\ce{CO2}$. Intenta usarlo para averiguar por qué $\ce{CO2}$ es lineal.