Esta respuesta estaba destinada como comentario para @WetSavannahanimal aka Rad Vance pero es bastante larga y llegué al límite de caracteres.
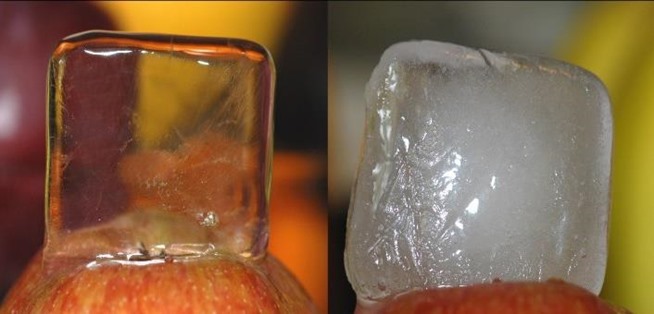
La razón por la opacidad en el centro debe ser debido a la forma en la que el volumen de agua se está congelando. Presumiblemente, la solución no está mezclada y el exterior se congela primero formando una pared cristalina (hielo) a través de la cual el gas no puede escapar. A medida que la pared se espese, el gas es liberado del agua que se solidifica en la solución central que queda. Esto concentra el gas en el líquido restante en el centro. Cuando la concentración de gas en esta solución alcanza el valor de saturación para el líquido en su estado actual, parte de este sale de la solución formando las cavidades, simultáneamente debería formarse algo de hielo, devolviendo la solución a la concentración de saturación. Esto se repite hasta que todo el agua está congelada.
La observación de que el hielo claro se hace burbujeando gas a través de él mientras se congela, indica que la mezcla de la solución permite que los gases saturados escapen de la superficie del volumen total de agua a medida que se forma el sólido en lugar de formarse en el centro.
Ahora uno podría preguntarse por qué no hay solamente una sola burbuja. La primera razón, desde el punto de vista de la solución a granel, es que el agua se está congelando incrementalmente formando burbujas a medida que avanza. Realmente está oscilando en torno al estado de equilibrio de la solución, que es el punto de saturación de gas de la solución congelante. Las condiciones exactas de este punto variarán ligeramente a medida que el líquido se congela. Es probable que la presión a la que se congeló el hielo en el centro sea mayor que la presión a la que se congeló el hielo de la superficie, por ejemplo, de manera similar, la temperatura a la que se congeló puede variar. Probablemente también hay un efecto de concentración, es decir, a medida que este punto de equilibrio se desplaza, el punto de saturación del gas también se desplazará, este cambio en la concentración también afecta un poco al punto de congelación. Hay alrededor de cuatro efectos (Temperatura, Presión, Volumen y Concentración de Gas) en juego durante la congelación. El segundo efecto, desde el punto de vista de un volumen finito, es que localmente alrededor de la cavidad, el agua podría experimentar una "ráfaga de gas" que podría congelar localmente una película de agua encapsulando la burbuja, de ahí el arreglo final complejo de cavidades y no la formación de una sola burbuja.
Es posible que se puedan ver estas diferencias en el punto de congelación utilizando el truco del polarizador. Solo lo he visto con plásticos transparentes hasta ahora pero debería funcionar aquí también. La próxima vez que vayas al cine, consigue un par de gafas 3D. Saca las dos lentes polarizadas y sujétalas a cada lado del cubito de hielo girándolas un poco, deberías ver la estructura cristalina interna del hielo como un enredo de líneas onduladas. Probablemente verás más un remolino o una dispersión en el centro cerca de las burbujas, lo que indica los cambios localizados en la estructura cristalina. Deberías comparar esto con el cubo transparente.
Hay otro truco que puedes probar. Si controlas la congelación del hielo hasta cierto punto podrías controlar la formación de las burbujas. Por ejemplo, nuestras bandejas de hielo son de plástico y tendemos a tener una capa superior clara con burbujas formándose en la parte inferior del cubo. Sospecho que el plástico retiene su calor y retrasa la congelación del fondo y del lado del cubo. Sospecho que si uno calentara o incluso enfriara la bandeja de hielo antes de formar el hielo se podría ver una formación diferente de cavidades (como se muestra en la segunda imagen aquí por ejemplo). Si usas una bandeja de hielo de metal deberías ver el efecto que has observado. Si combinas una bandeja de hielo de metal y una de plástico juntas podrías obtener más burbujas más cerca del lado de plástico. Incluso podrías obtener un efecto de lunares/explosión/combinación pintando pegamento en el interior de una bandeja de metal, o sostener una varilla de metal dentro del volumen mientras lo congelas. Aunque podrías estar agregando puntos para que se forme gas y escape, resultando en cubos transparentes. Alternativamente, podrías simplemente obtener un carrat (sombrero). Este Compañero parece haber hecho mucho trabajo duro por ti. Beneficiosamente parece disfrutar bebiendo sus experimentos después (Tu resultado podría variar).
Si estás realmente interesado deberías verificar si la NASA realizó experimentos de congelación en el espacio, podría mostrar otros métodos mediante los cuales se podría controlar la formación de burbujas. De manera similar, podrías encontrar imágenes de cámara rápida de congelación durante las cuales deberías ver algunos efectos interesantes mientras se forman las burbujas (Aunque es un uso un poco contradictorio de estas cámaras y dudo que las personas que las poseen hayan pensado en usarlas con este propósito).



13 votos
No sé cómo este método mencionado hace el truco, pero según mi conocimiento, la blancura del hielo son miles de burbujas de aire. El cubo de hielo transparente está más cerca de ser completamente cristalino sin cavidades que den superficies internas para dispersar la luz.
0 votos
Entonces, ¿tal vez hervir reduce la cantidad de aire disuelto al "agitarlo" violentamente mientras hierve? Eso podría ser probado entonces también simplemente agitando una botella de agua antes de congelarla.
2 votos
@andynitrox O también podrías esperar solo un día después de hervir para ver si los gases se diluyen de nuevo (deberían en teoría) y eso debería producir "hielo blanco" nuevamente.
2 votos
Lo haré. Actualizaré la pregunta con algunos resultados del experimento.
0 votos
Hm. El experimento no funcionó correctamente: todos los cubos de hielo estaban igualmente nublados. ¿Quizás hervirlo dos veces ayude?
0 votos
Desde una perspectiva de gases disueltos, hervir una vez debería ser suficiente. Vierte el agua en la jarra para asegurarte de que sea la misma.
0 votos
El agua es la misma (ambas del mismo grifo) y se llenó en tazas idénticas para congelar. El agua a temperatura ambiente tenía una capa de hielo transparente de aproximadamente 5 mm de espesor en los lados, mientras que el agua hervida estaba completamente lechosa. El agua que se hirvió y se dejó enfriar, así como el agua que se agitó, tenía el mismo color que la hervida.
3 votos
¿Esos cubos están encima de una manzana?
0 votos
@Insane sí, parece que sí. (La imagen fue tomada de internet)
0 votos
@andynitrox los minerales también juegan un papel. El sarro, etc... algunos de estos se convierten en formas insolubles al hervir, pero otros permanecen en el agua.
0 votos
¿Significa eso que pones agua caliente en el congelador? La diferencia es que la circulación durante la congelación es mucho mayor. ¡He visto hielo transparente hecho manteniéndolo en circulación mientras se congela... usando un burbujeador!
2 votos
Para que conste, agitar agua tenderá a disolver más gas en ella, ya que desplazará ligeramente el equilibrio en esa dirección. (Agitar refresco liberará gas, pero eso es porque comienza mucho fuera de equilibrio, y la agitación facilita la reacción.)
0 votos
@andynitrox El hecho de que hervir agua desgasifica no tiene nada que ver con agitar. Más bien, se debe a que la solubilidad de los gases en los líquidos disminuye con el aumento de la temperatura, lo cual se debe a que la mayor temperatura da a las moléculas de gas más energía para salir de la solución. Por eso los océanos polares son tan ricos en vida: hay una gran cantidad de oxígeno disuelto en el agua fría.
0 votos
Soy un gran fan de cómo las imágenes aquí demuestran que las manzanas son el mejor dispositivo único para usar como soporte en la documentación experimental. Lo que probablemente explica por qué los científicos siempre preguntan "¿Pero se ve diferente en una manzana?" cuando se enfrentan a resultados experimentales controvertidos.
0 votos
@DavidRicherby sí, también pensé en eso después. Parece que esto respalda que el agua agitada también da como resultado hielo nublado. Hasta donde sé, disminuir la presión también desgasifica un fluido. Esta sería entonces la solución más simple y rápida para obtener hielo claro (siempre que tengas acceso a una bomba de vacío)
0 votos
@Jim Eres libre de buscar imágenes mejores de este efecto. A mí me gustó esta, ya que muestra claramente la diferencia y estaba fácilmente disponible en línea.
0 votos
@andynitrox Creo que más personas tienen acceso a cosas que pueden hervir agua que tienen acceso a una bomba de vacío...
0 votos
@andynitrox No, no. Me gusta la imagen. La ciencia necesita un poco de capricho