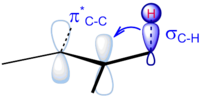
A continuación se muestra una imagen de efecto hiperconjugador . Podemos ver un σ -par de electrones deslocalizadores orbitales con un πX∗ - orbital.
![hyperconjugation movement]()
La explicación a su problema puede darse decidiendo si el efecto es "centralizado" o "descentralizado". Te lo explico con un ejemplo.
Una escena rápida :
Supongamos que tú y tu amigo estáis sentados en un barco ( CXyou=CXfriend ) en medio de un río, y ambos tienen que llegar pronto a cualquiera de las dos orillas (un proceso similar a la deslocalización, probablemente). Supongamos que los grupos de metilo son los remos que necesitan para cruzar el río.
En RX2CXyou=CXfriendHX2 , los dos remos están con usted . Así, sólo tú puedes remar la barca y, por tanto, ambos podéis llegar pronto a la orilla. Técnicamente, el β-H están en un carbono, por lo que el efecto sólo puede producirse en él, de ahí que esté "centralizado" y sea superrápido.
Pero, en RHCXyou=CXfriendHR , ambos tienen los remos . Así, ambos pueden remar el bote y por lo tanto ambos llegarán a cualquiera de las orillas a un poco más tarde . Técnicamente, el β-H se distribuyen por igual entre los carbonos, por lo que el efecto puede producirse en cualquiera de los dos lados, de ahí que sea "descentralizado" y no tan rápido como en el caso anterior.
En cuanto a su preocupación por los factores estéricos, debe saber que el "alquilo" se refiere a una cadena recta de hidrocarburos, y no es tan voluminoso como para crear un "obstáculo estérico".
Supongo que eso tiene algún sentido :)
EDITAR: Lo anterior explica que el primer isómero es el más estable. Anteriormente había dicho que los "efectos estéricos" no importan, pero en el caso de cis y trans isómeros, importa y es lo único que los diferencia (junto con la polaridad). Debido a esto, cis es el menos estable de los tres.
Tabla de referencia de \ce{\Delta H^°_f} : http://ursula.chem.yale.edu/~chem220/chem220js/STUDYAIDS/thermo/heats-formation.html#Alquenos (en #C = 4)