Según mi libro de texto, la adición de bromo al pent-1-en-4-ino a baja temperatura produce 4,5-dibromopent-1-ino:
¿Por qué se produce selectivamente la bromación del doble enlace?
Por "más reactivo" entiendo que el alqueno sufre la bromación a mayor velocidad que el alquino, lo que parece implicar que la energía de activación del estado de transición es mayor.
Una perspectiva cinética
La formación del ion bromonio implica un estado de transición cíclico en el que el enlace Br-Br es atacado por el enlace pi del alqueno/alquino, y el enlace pi se dona al orbital antienlace sigma* para formar un enlace sigma C-Br. Al hacerlo, ambos carbonos del alqueno/alquino tendrán sus orbitales p hibridizados con el orbital sp/sp2 para formar el orbital sp2/sp3 respectivamente. Sin embargo, el orbital de enlace sp2 tendrá más tensión en el anillo, ya que existe de forma natural con ángulos de enlace de 120 grados de separación de otros orbitales sp2, mientras que el orbital sp3 está algo menos tenso con ángulos de enlace ~109,5 grados de separación. Por lo tanto, el estado de transición de mayor energía hará que el alquino sea menos reactivo, y la bromación se producirá primero en el alqueno.
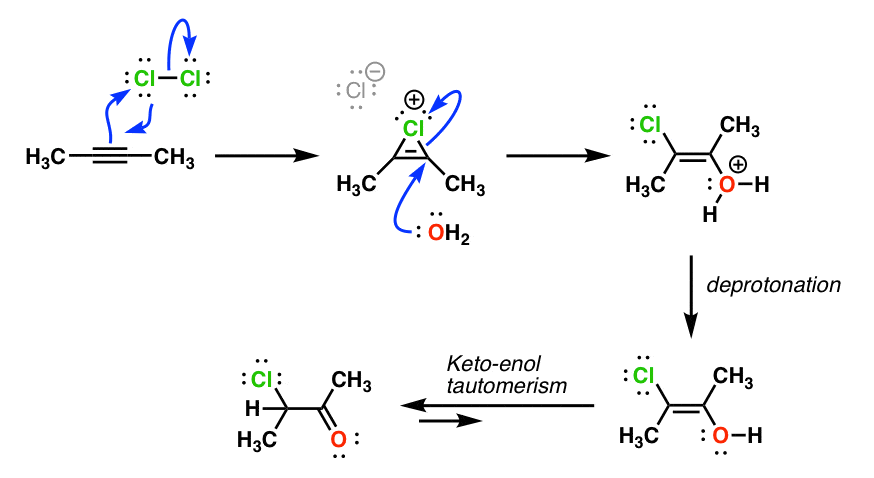
Además, (como se señaló aquí : https://www.masterorganicchemistry.com/2013/05/29/alkyne-addition-pathways-the-3-membered-ring-pathway/ ) los orbitales p del Cl se conjugan con el enlace pi del estado de transición del alqueno, dando lugar a un estado de transición de 4 electrones. antiaromático ¡Sistema! Esto aumenta aún más la inestabilidad del estado de transición y provoca una reacción más lenta.
TL;DR: Hay más tensión anular en el estado de transición del alqueno porque los carbonos están hibridizados sp2, y su estado de transición implica la formación de un anillo antiaromático, por lo que la reacción se produce más lentamente que la bromación en el alqueno.
Un doble enlace carbono-carbono mide aproximadamente 133 pm; un triple enlace carbono-carbono mide 120 pm. Parece que los enlaces pi en un doble enlace son un poco más difusos y podrían ser un poco más atractivos para un ion bromonio.
La especificación de "baja temperatura" sugiere que la selectividad no es muy grande. Sería interesante conocer la proporción de productos a diferentes temperaturas.
En general, la adición halo es una adición 'Electrofílica', no una adición 'Nucleofílica' y por lo tanto es $\ce{Br+}$ que ataca primero al hidrocarburo saturado.
Pasemos ahora a su pregunta, De acuerdo con Jerry March (4 ª edición, Pg748) Química Orgánica Avanzada ,
Hay una mayor concentración de electrones entre el carbonos del triple enlace que en un doble enlace, y sin embargo los triples están menos sujetos al ataque electrofílico y más sujetos al ataque al ataque nucleofílico que el doble enlace.
La causa probable, sugerida por Sujith, parece una explicación bastante razonable respaldada por el hecho de que, mientras que las adiciones con intermedios "puenteados" reaccionan más rápidamente con los dobles enlaces, las adiciones sin dichos intermedios reaccionan casi al mismo ritmo con ambas entidades.
I-Ciencias es una comunidad de estudiantes y amantes de la ciencia en la que puedes resolver tus problemas y dudas.
Puedes consultar las preguntas de otros usuarios, hacer tus propias preguntas o resolver las de los demás.
1 votos
Sería una pregunta mucho más completa si mencionaras el disolvente y la temperatura a la que se produce la reacción. Estas cosas suelen afectar mucho a la velocidad de reacción.