¿Cuál es la diferencia entre estabilidad termodinámica y cinética? Me gustaría una explicación básica, pero no demasiado simple. Por ejemplo, el metano no se quema hasta que se enciende, ¿por qué?
¡Esta es una respuesta excepcional!
¿Cuál es la diferencia entre estabilidad termodinámica y cinética? Me gustaría una explicación básica, pero no demasiado simple. Por ejemplo, el metano no se quema hasta que se enciende, ¿por qué?
Para comprender la diferencia entre la estabilidad cinética y termodinámica, primero tienes que entender superficies de energía potencial, y cómo están relacionadas con el estado de un sistema.
Una superficie de energía potencial es una representación de la energía potencial de un sistema en función de una o más de las otras dimensiones de un sistema. Comúnmente, las otras dimensiones son espaciales. Las superficies de energía potencial para sistemas químicos suelen ser muy complejas y difíciles de dibujar y visualizar. Afortunadamente, podemos facilitar las cosas comenzando con modelos 2D simples, y luego extender esa comprensión al caso generalizado de N-dimensiones.
Entonces, vamos a empezar con el tipo más fácil de energía potencial de entender: la energía potencial gravitatoria. Esto es fácil para nosotros porque vivimos en la Tierra y estamos afectados por ella todos los días. Hemos desarrollado un sentido intuitivo de que las cosas tienden a moverse desde lugares más altos hacia lugares más bajos, si se les da la oportunidad. Por ejemplo, si te muestro esta imagen:

Puedes adivinar que la roca eventualmente rodará cuesta abajo, y finalmente se detendrá en el fondo del valle.
Sin embargo, también sabes intuitivamente que no se va a mover a menos que algo lo haga. En otras palabras, necesita algo de energía cinética para empezar a moverse.
Puedo hacer que sea aún más difícil para la roca ponerse en movimiento cambiando un poco la superficie:
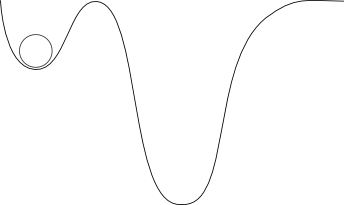
Ahora es muy obvio que la roca no va a moverse hasta que adquiera suficiente energía cinética para superar la pequeña colina entre el valle en que se encuentra, y el valle más profundo a la derecha.
Llamamos al primer valle un mínimo local en la superficie de energía potencial. En términos matemáticos, esto significa que la primera derivada de la energía potencial con respecto a la posición es cero:
$$\frac{\mathrm dE}{\mathrm dx} = 0$$
y la segunda derivada es positiva:
$$\frac{\mathrm d^2E}{\mathrm dx^2} \gt 0$$
En otras palabras, la pendiente es cero y la forma es cóncava hacia arriba (o convexa).
El valle más profundo a la derecha es el mínimo global (al menos hasta donde podemos decir). Tiene las mismas propiedades matemáticas, pero la magnitud de la energía es más baja: el valle es más profundo.
Si juntas todo esto, (y puedes tolerar un poco de antropomorfización) podrías decir que la roca desea llegar al mínimo global, pero si puede llegar o no se determina por la cantidad de energía cinética que posee.
Necesita al menos suficiente energía cinética para superar todos los máximos locales a lo largo del camino entre su mínimo local actual y el mínimo global.
Si no tiene suficiente energía cinética para moverse de su posición actual, decimos que es estable cinéticamente o atrapado cinéticamente. Si ha alcanzado el mínimo global, decimos que es estable termodinámicamente.
Para aplicar este concepto a sistemas químicos, tenemos que cambiar la energía potencial que usamos para describir el sistema. La energía potencial gravitatoria es demasiado débil para desempeñar un papel importante a nivel molecular. Para sistemas grandes de moléculas reaccionantes, en su lugar observamos una de varias energías potenciales termodinámicas. La que elegimos depende de qué variables de estado son constantes. Para reacciones químicas macroscópicas, generalmente hay un número constante de partículas, temperatura constante, y ya sea presión constante o volumen constante (NPT o NVT), y por lo tanto utilizamos la energía libre de Gibbs ($G$ para sistemas NPT) o la energía libre de Helmholtz ($A$ para sistemas NVT).
Cada una de estas es un potencial termodinámico bajo condiciones apropiadas, lo que significa que hace lo mismo que la energía potencial gravitatoria: nos permite predecir hacia dónde irá el sistema, si tiene la oportunidad de hacerlo.
Para la energía cinética, no tenemos que cambiar mucho: la principal diferencia entre la energía cinética de una roca en una colina y la energía cinética de una gran colección de moléculas es cómo la medimos. Para partículas individuales, podemos medirla utilizando la velocidad, pero para grandes grupos de moléculas tenemos que medirla utilizando la temperatura. En otras palabras, aumentar la temperatura aumenta la energía cinética de todas las moléculas en un sistema.
Si podemos describir la energía potencial termodinámica de un sistema en diferentes estados, podemos averiguar si una transición entre dos estados es favorable termodinámicamente: podemos calcular si la energía potencial aumentaría, disminuiría o se mantendría igual.
Si miramos todos los estados accesibles y decidimos que el que estamos en el tiene la energía potencial termodinámica más baja, entonces estamos en un estado termodinámicamente estable.
En el ejemplo de usar gas metano, podemos analizar la energía libre de Gibbs para los reactivos y productos y decidir que los productos son más termodinámicamente estables que los reactivos, y por lo tanto el gas metano en presencia de oxígeno a 1 atmósfera y 298 K es termodinámicamente inestable.
Sin embargo, tendrías que esperar mucho tiempo para que el metano reaccione sin ayuda externa. La razón es que los estados de transición a lo largo de la ruta de reacción de menor energía tienen una energía potencial más alta que la energía cinética promedio de los reactivos. Los reactivos están atrapados cinéticamente - o estables simplemente porque están atrapados en un mínimo local. La cantidad mínima de energía que necesitarías proporcionar en forma de calor (un fósforo encendido) para superar esa barrera se llama la energía de activación.
Este concepto se puede aplicar a muchas otros sistemas también. Uno de los ejemplos más famosos aún extensamente investigados son los vidrios.
Los vidrios son interesantes porque son ejemplos de estabilidad cinética en fases físicas. Normalmente, los cambios de fase son regulados por la estabilidad termodinámica. En sólidos vítreos, las moléculas tendrían una energía potencial más baja si estuvieran dispuestas en una estructura cristalina, pero como no tienen la energía necesaria para salir del mínimo local, quedan "atrapadas" con una estructura desordenada semejante a un líquido, a pesar de que la fase es sólida.
La cinética se ocupa de todo lo que afecta a la velocidad a la que ocurre una reacción. Una implicación de eso es que la cinética de reacción es parcialmente una función de la estabilidad de las especies intermedias (y estados de transición) que la vía de una reacción química necesariamente debe pasar en camino a la formación del producto final. Si esos intermediarios son altamente inestables (es decir, altamente energéticos) en relación a los reactivos iniciales, entonces la barrera inicial de energía de activación que se debe superar para iniciar la reacción será relativamente alta, y la reacción tiende a avanzar lentamente (si es que avanza).
La estabilidad termodinámica, por otro lado, es estrictamente una función del cambio en la energía libre (ΔG), que es una función de estado, lo que significa que su valor está determinado exclusivamente por la diferencia entre el estado inicial y el estado final (o la energía libre de los productos iniciales y finales). En otras palabras, la estabilidad termodinámica es totalmente independiente de la vía entre reactivos y productos.
Aunque es cierto que la estabilidad termodinámica es el árbitro final de la espontaneidad de una reacción, si la cinética hace que la reacción sea demasiado lenta, entonces, en la práctica, la reacción puede que en realidad no ocurra (bajo un cierto conjunto de condiciones). El ejemplo clásico de libro de texto es la conversión de diamante a grafito, que es favorable termodinámicamente porque la energía libre del grafito es menor, pero no ocurre bajo condiciones ordinarias porque la cinética de la reacción (en forma de la inmensa energía de activación requerida) es extremadamente desfavorable.
Imagina que tienes algún conjunto de reactivos, A + B, y hay dos vías diferentes a través de las cuales A + B pueden reaccionar, ambas de las cuales conducen a productos finales que son más bajos en energía libre que los reactivos A + B. La Vía #1 tiene una energía de activación mucho más alta que la Vía #2, pero los productos finales al final de la Vía #1 son más bajos en energía libre (es decir, más termodinámicamente estables) que los de la Vía #2. Esto significa que la Vía #1 es favorecida termodinámicamente, pero la Vía #2 es favorecida cinéticamente (es decir, presenta una barrera más baja en términos de energía de activación y la reacción procederá más rápidamente a través de esta vía). La consecuencia de esto es que la vía cinética, Vía #2, será la favorecida, a menos que las condiciones ambientales (temperatura, presión, concentraciones de catalizadores, etc.) estén ajustadas de tal manera que la energía de activación más alta de la Vía #1 pueda ser superada.
En resumen, la estabilidad termodinámica (en términos de diferencia de energía libre entre reactivos y productos) determinará si una reacción dada podría ser teóricamente espontánea, pero los factores cinéticos decidirán si la reacción ocurre en la práctica bajo las condiciones ambientales dadas, así como qué vía para una reacción dada toma primacía.
El primer párrafo tiene puntos que son un buen complemento al post de Thomij y no fueron explícitamente mencionados allí. +1
@Greg E. "Una implicación de eso es que la cinética de reacción es parcialmente una función ... el producto final." Por lo tanto, la energía de activación depende parcialmente de la estabilidad. ¿Podemos decir que la cinética depende de la termodinámica mientras que la termodinámica no lo hace?
A menudo hay una "barrera de reacción" que debe ser superada. Por lo tanto, se debe suministrar energía para iniciar la reacción, pero una vez iniciada se vuelve autosostenible.
Se puede pensar de esta manera: uno tiene que romper enlaces en una reacción antes de poder hacer enlaces nuevos. Se necesita energía para romper los primeros enlaces. Luego, hacer nuevos enlaces puede suministrar suficiente energía para mantener la reacción en marcha.
Nótese que estoy hablando de reacciones permitidas termodinámicamente. Si una reacción no está permitida termodinámicamente, entonces aunque algunos enlaces sean rotos al añadir energía, la reacción no continuará espontáneamente.
Entonces, ¿quieres decir que la energía de activación, por ejemplo, es estabilidad cinética? Sin embargo, todavía no entiendo la estabilidad termodinámica, ¿tiene algo que ver con la entropía, ya que sé qué reacciones son espontáneas al calcular su Delta S Total?
@Cyrus: Sí, la energía de activación tiene que ver con la estabilidad cinética. Por ejemplo, los diamantes son termodinámicamente inestables en comparación con el grafito, pero no contengas la respiración esperando la conversión espontánea. La segunda mitad es más compleja. La cantidad termodinámica que predice la dirección de una reacción depende de las condiciones del proceso que se está considerando. Por ejemplo, a temperatura y presión constantes $T$, la energía libre de Gibbs $\Delta G$, debe ser negativa. A temperatura y volumen constantes $E$, el cambio de entropía $\Delta S$ debe ser positivo.
Cinético - cómo reacciona algo de forma no deseada. Termodinámico - las energías involucradas, la cantidad de gradiente.
Por ejemplo, el aluminio es cinéticamente mucho más estable que el hierro en aire húmedo (no se oxida), pero termodinámicamente mucho menos estable (si se oxidara, liberaría más energía).
Eres termodinámicamente inestable en aire, pero no te preocupes, no vas a inflamarte espontáneamente, lo cual es otra forma de decir que eres cinéticamente estable.
La estabilidad cinética se refiere a las condiciones de pre-equilibrio. Por ejemplo, la constante de equilibrio K puede ser muy grande, lo que significa que la formación del producto es favorable, pero la condición es tal que la reacción no avanza (o avanza extremadamente lentamente).
La estabilidad termodinámica se refiere a un sistema en el que la formación de productos no es favorable. Por ejemplo, tenemos un cociente de reacción mayor, Q.
Una reacción puede ser termodinámicamente inestable pero cinéticamente estable porque las condiciones son tales que la velocidad de la reacción es cero. Una mezcla de carbón y oxígeno es cinéticamente estable porque las condiciones para la combustión no se obtienen hasta que el carbón se calienta a su temperatura de ignición. El sistema es termodinámicamente inestable porque en equilibrio la reacción del carbón con oxígeno favorece la formación de $\ce{CO2}$.
I-Ciencias es una comunidad de estudiantes y amantes de la ciencia en la que puedes resolver tus problemas y dudas.
Puedes consultar las preguntas de otros usuarios, hacer tus propias preguntas o resolver las de los demás.
1 votos
¿Cuáles son tus impresiones iniciales al respecto? Será útil para quienes respondan poder evaluar tu comprensión actual.