Asimétrica dimethylhydrazine (HX2NN(CHX3)X2) tiene un punto de fusión de -57 °C, pero su isómero, el 1,2-dimethylhydrazine ((CHX3NH)X2) tiene un punto de fusión de -9 °C. Que a mí me parece una diferencia significativa, por lo que debe haber algún mecanismo que hace que estos dos compuestos muy diferentes en este sentido. Sin embargo, soy incapaz de averiguar por qué esa diferencia existe; podría por favor explicar eso?
Estas son las estructuras de los compuestos (de wikimedia commons):
Asimétrica dimethylhydrazine:

1,2-dimethylhydrazine:
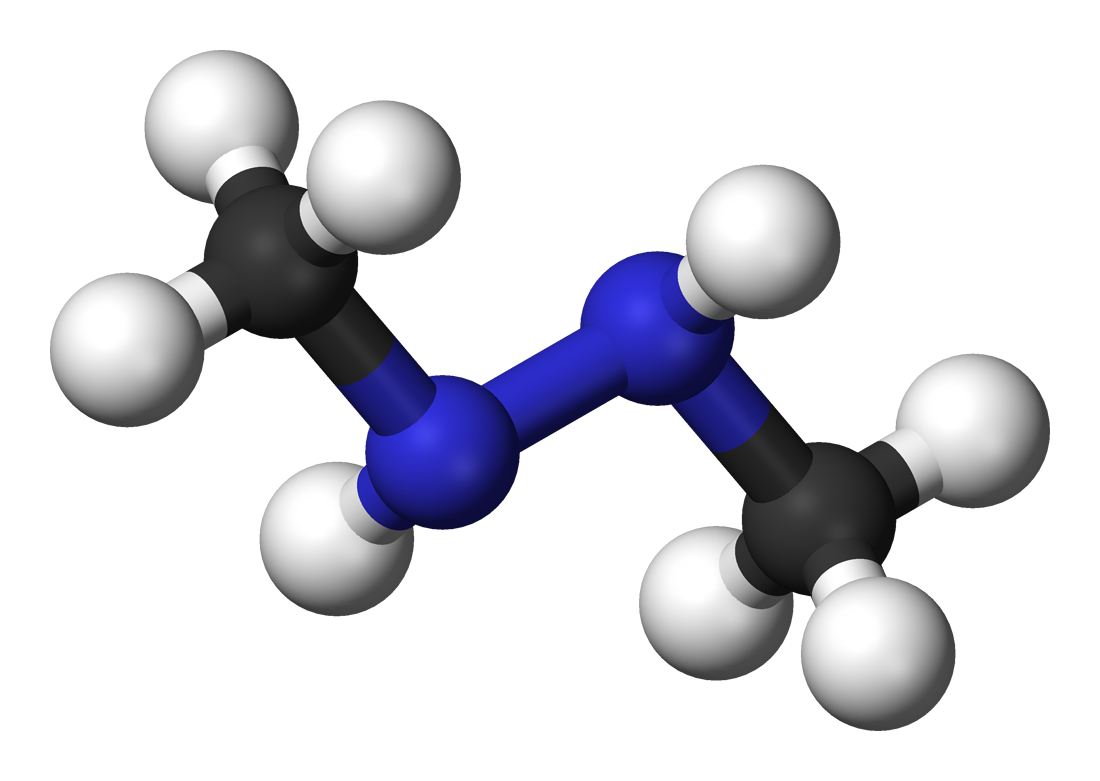
Aquí están algunos de los argumentos que he considerado que:
El embalaje en las estructuras cristalinas podría ser "diferente" en una manera significativa. Esto podría ser apoyada por el hecho de que la diferencia entre sus puntos de ebullición es mucho menor: asimétrica dimethylhydrazine tiene un punto de ebullición de 64 °C, mientras que el 1,2-dimethylhydrazine es de 87 °C. sin Embargo, esta es una muy vago argumento; podría ser reforzado por algunos detalles acerca de cómo los diferentes envases contribuir a los puntos de fusión.
Enlace de hidrógeno debe ser un muy importante factor a tener en cuenta durante el análisis de estos compuestos. Yo sospechaba que el impedimento estérico puede permitir sólo una N átomo de hidrógeno en asimétricas dimethylhydrazine. Sin embargo, esto podría sugerir que el 1,2-dimethylhydrazine debe tener un menor punto de fusión, lo que evidentemente no es el caso.
Tuvimos una discusión acerca de estos dos compuestos de puntos de fusión en la Física SE charla un rato, así que pensé en meter aquí y preguntar.



