Mi libro de texto dice
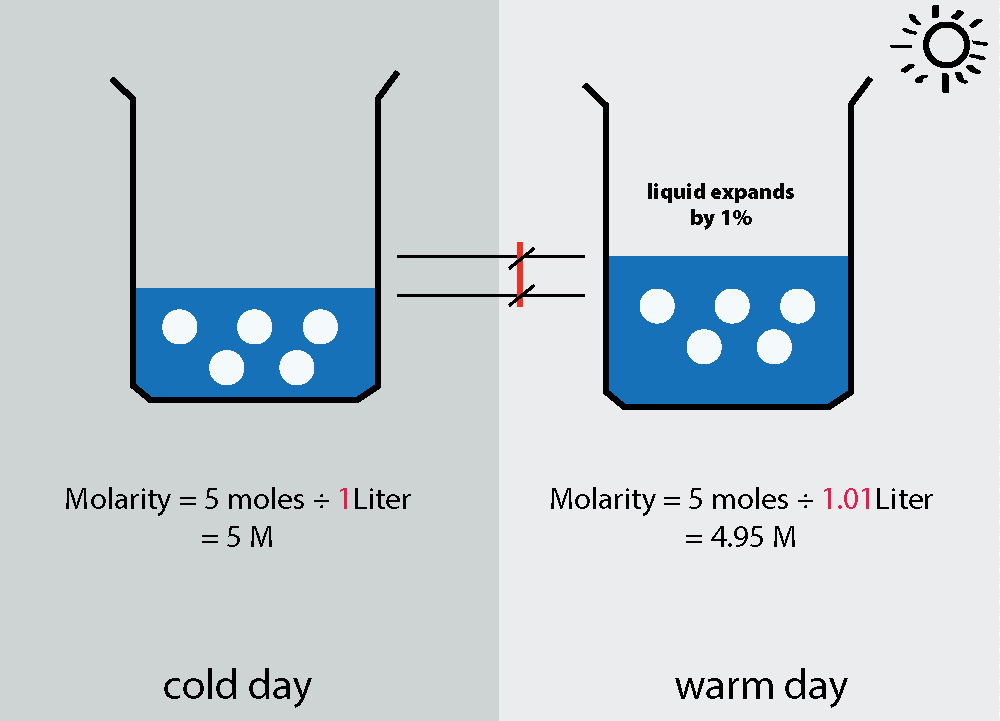
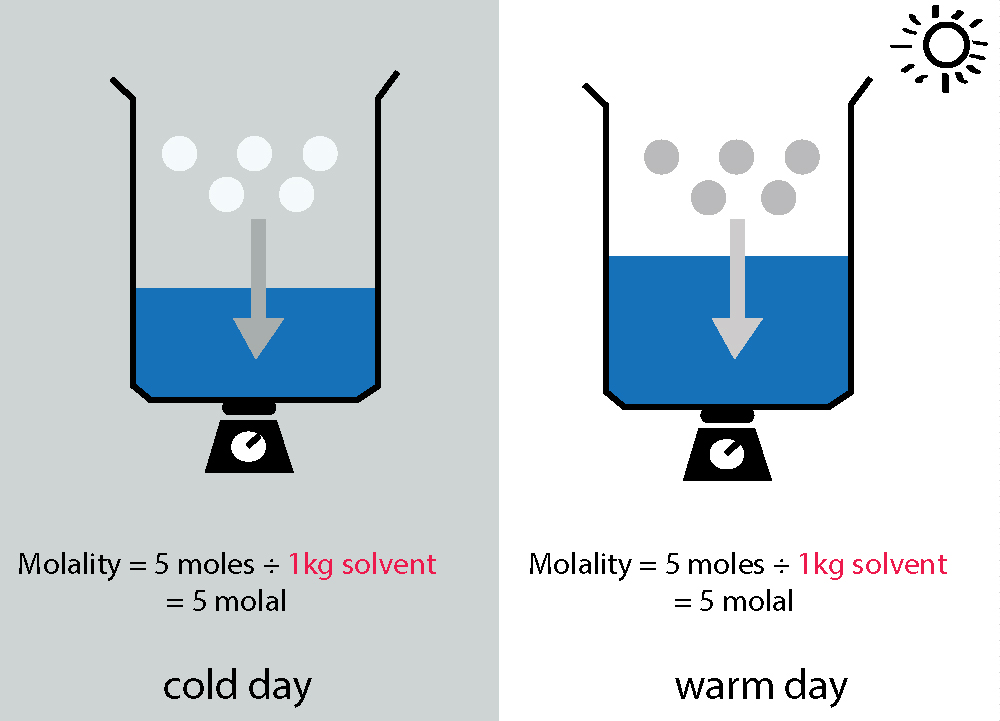
La molaridad depende de la temperatura, mientras que la molalidad no.
Soy consciente de las definiciones tanto de la molaridad como de la molalidad, pero considera este escenario:
Una solución de NaCl en HX2O se calienta. Eventualmente, toda el agua se evaporará y solo quedarán cristales de NaCl. Al final, no hay solvente para medir la concentración de lo que antes era una solución. En este caso, ¿cómo sigue siendo válido el argumento "la molalidad es independiente de la temperatura"?



3 votos
En tu ejemplo extremo, obviamente no lo hace. No hay solución que mencionar, por lo que realmente no puedes definir una concentración, ya sea en términos de molaridad o molalidad. Dado que la molaridad es moles por volumen de solución, es sensible a la temperatura (ya que el volumen cambia con la temperatura). No hay tales problemas con la molalidad ya que se define como moles sobre la masa del disolvente (que no cambia).
0 votos
En términos formales, la molalidad no cambia si se tiene en cuenta el vapor. De lo contrario, simplemente estás engañando al eliminar masa del solvente en lugar de simplemente cambiar su temperatura.
0 votos
No puedes cambiar la composición de una fase y esperar que las concentraciones no cambien. Además, aplicar calor a una solución no significa necesariamente que el solvente se evaporará. No lo hace cuando el sistema está cerrado y consiste solo en la fase de la solución.
2 votos
Ambos son cantidades de soluciones. Si evaporas todo el disolvente, la molaridad y la molalidad ya no tienen ningún significado.
0 votos
Al pensarlo bien, todo el agua eventualmente escapará incluso si no calientas la solución en absoluto. ¿Qué sucederá con la molaridad?